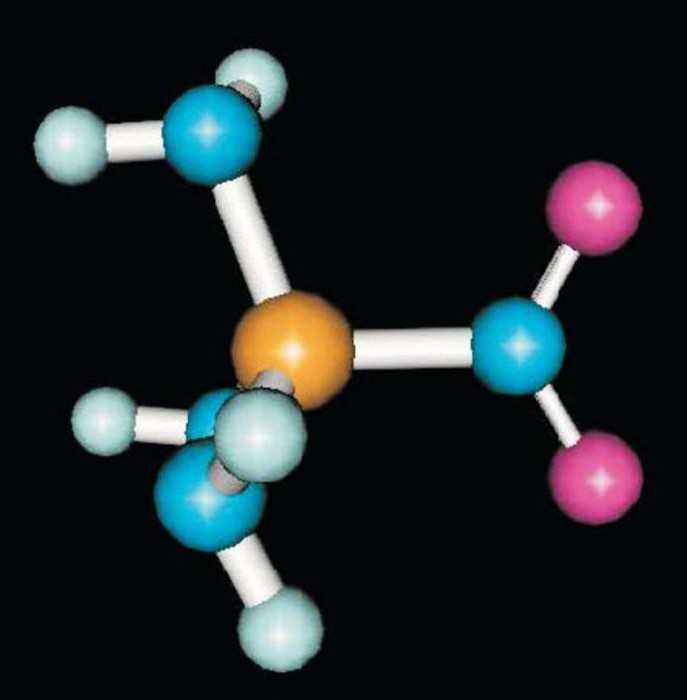
Стирол
Содержание:
Реакции замещения
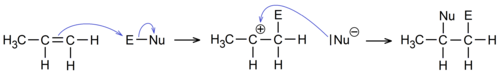
| Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.). |
2.1. Галогенирование
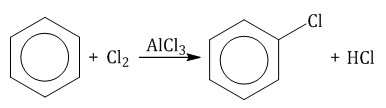
Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:
Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо.
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:
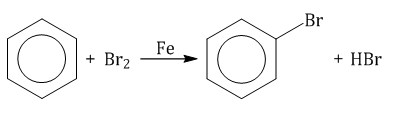
|
Гомологи бензола содержат алкильные заместители, которые обладают электронодонорным эффектом: из-за того, что электроотрицательность водорода меньше, чем углерода, электронная плотность связи С-Н смещена к углероду.
На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо. |
| Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения |
| Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола |
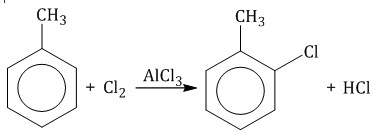
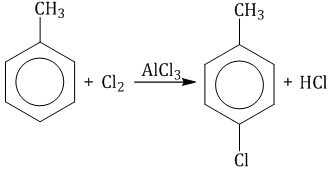
Мета-хлортолуол образуется в незначительном количестве.
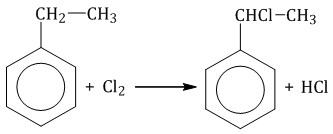
При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300оС) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.
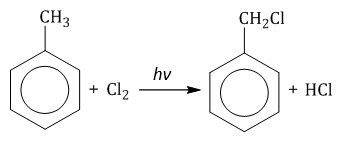
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
Например, при хлорировании этилбензола:
2.2. Нитрование
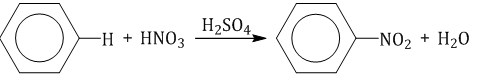
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:
| Серная кислота способствует образованию электрофила NO2+: |
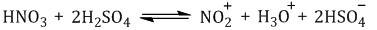
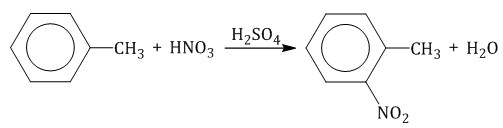
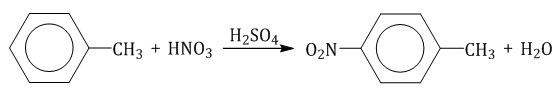
Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:
либо п-нитротолуол:
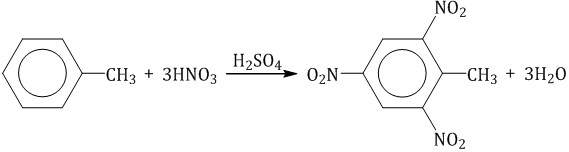
Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):
2.3. Алкилирование ароматических углеводородов
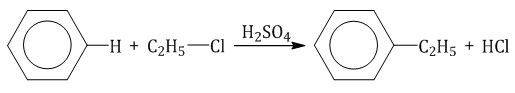
Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
| Например, бензол реагирует с хлорэтаном с образованием этилбензола |
Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
| Например, бензол реагирует с этиленом с образованием этилбензола |
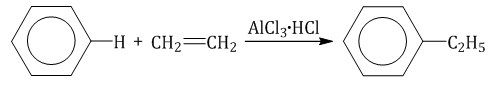
| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |
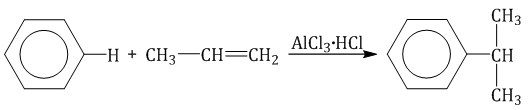
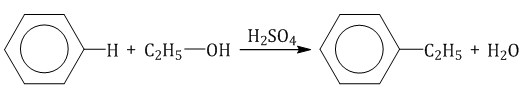
Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
| Например, бензол реагирует с этанолом с образованием этилбензола и воды |
2.4. Сульфирование ароматических углеводородов
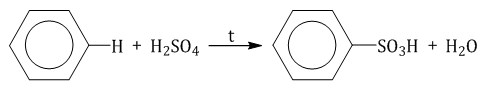
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:
Производство
На сегодняшний день существует несколько принципиально различных способов производства бензола.
- Коксование каменного угля. Этот процесс исторически был первым и служил основным источником бензола до Второй мировой войны. В настоящее время доля бензола, получаемого этим способом, составляет менее 10 %. Следует добавить, что бензол, получаемый из каменноугольной смолы, содержит значительное количество тиофена, что делает такой бензол сырьем, непригодным для ряда технологичных процессов.
-
Каталитический риформинг (аромаизинг) бензиновых фракций нефти. Этот процесс является основным источником бензола в США. В Западной Европе, России и Японии этим способом получают 40—60 % от общего количества вещества. В данном процессе кроме бензола образуются толуол и ксилолы. Ввиду того, что толуол образуется в количествах, превышающих спрос на него, его также частично перерабатывают в:
- бензол — методом гидродеалкилирования;
- смесь бензола и ксилолов — методом диспропорционирования.
- Пиролиз бензиновых и более тяжелых нефтяных фракций. До 50 % бензола производится этим методом. Наряду с бензолом образуются толуол и ксилолы. В некоторых случаях всю эту фракцию направляют на стадию деалкилирования, где и толуол, и ксилолы превращаются в бензол.
-
Получение бензола методом Реппе
Тримеризация ацетилена — при пропускании ацетилена при 400 °C над активированным углем с хорошим выходом образуется бензол и другие ароматические углеводороды: 3С2Н2 → С6H6. Получение бензола из ацетилена связывают с именем Марселена Бертло, работы которого были начаты в 1851 году. Однако продуктом реакции по методу Бертло, протекавшей при высокой температуре, являлась, кроме бензола, сложная смесь компонентов. Лишь в 1948 году В. Реппе удалось найти подходящий катализатор — никель — для снижения температуры реакции. Полностью механизм реакции был описан только в 2020 году сотрудниками Института органической химии им. Н. Д. Зелинского РАН.
Измерение концентрации стирола| как влияет стирол на организм человека

Искусственные строительные и отделочные материалы при их экономичности, хороших функциональных свойствах, эстетичности содержат вещества, вредные для здоровья. Больше 50% полимеров для строительства производят из стирола, который относят к группе опасных веществ.
Свойства стирола
Производят стирол (винилбензол) промышленным способом из этилбензола методом дегидрирования (лат. de – ‘устранение’ + греч. hydor – ‘вода’). Прозрачная жидкость со специфическим запахом, он слабо растворяется водой, хорошо – органическими растворителями; растворяет полимеры.
Химико-физические свойства стирола определяют его вреддля здоровья. Состоит из молекул летучих газов углерода и водорода (формула С8Н8). Легко окисляется, присоединяет элементы, которые образуют соль при соединении с металлами (галогены). Из-за лёгкого воспламенения входит в состав напалма – горючей смеси с температурой горения до 1600º.
Человека в помещении окружают материалы, содержащие стирол:
— пенополистирол (в утеплителях, виниловых обоях, линолеуме, пластике для облицовки, декоративных изделиях, стеклопакетах);
— акрил (бытовая техника, мебель, игрушки);
— полиэфиры (эпоксидные и алкидные смолы, поликарбонаты) и др.
https://youtube.com/watch?v=Pxup2CjP2DQ
Из суммарных испарений, выделяемых строительными и отделочными полимерными материалами, складывается концентрация стирола в воздухе.
Воздействие стирола и его опасность для человека
Стирол – общетоксический слабый яд, неприятный запах которого ощущается при концентрации от 0,07 мг/м³. Обладает нейротоксическим, наркотическим, раздражающим, судорожным действиями.
Средняя летальная для человека доза – 10000 мг/м3. Коэффициент кумулятивности в организме (лат. cumulate – ‘накапливать’) 0,7005, ср. окись углерода – 0,1195. Пути попадания – вдыхание (наиболее частый), через кожу при контакте со стиролосодержащими жидкостями.
Повышенная концентрация стирола опасна. Один из источников испарений – пенопласт. Выделение стирола из пенопласта при естественном износе материалов увеличивается с возрастанием эксплуатационных сроков, может достигать 2/3 от разложившихся веществ.
Длительное (многолетнее) вдыхание высоких концентраций стирола вызывает серьезные отклонения:
— острые и хронические заболевания;
— повышение онкологических рисков, у женщин – патологии развития плода;
— нарушение функционирования вегетативной нервной системы;
Вопрос, как влияет стирол на организм человека, – это проблема длительности воздействия опасной для здоровья концентрации.
О нормах концентрации стирола в воздухе
Стирол входит во 2-й класс (высокоопасный) из четырёх классов опасных веществ. Предельная концентрация стирола в помещении, при которой он не окажет вреда, регламентируется законодательно: федеральным законом №52-ФЗ (ред. 28 ноября 2015), приказом Минздрава №325.
Установлены параметры двух видов ПДК для стирола:
— максимальная разовая – 0,04 мг/ дм3 (40 мкг/м3). Это показатель концентрации за 20 мин, вызывающей быстрое, но временное действие;
— среднесуточная ПДК за год – 0,002 мг/дм3 (2 мкг/м3).
Европейское сообщество по ограничению использования и производства химических веществ (REACH) на основе систематизации данных ответило на вопрос, как влияет стирол на здоровье. В концентрациях, не превышающих ПДК, он не оказывает мутагенного и канцерогенного воздействия.
Как узнать содержание стирола в доме
Выезд специалиста и применение современного оборудования для комплексного химического анализа воздуха и материалов из полимеров помогут установить концентрацию вредных веществ, её соответствие ПДК, получить официальное заключение о свойствах стройматериалов, вызывающих сомнение, их соответствии ГОСТам и техническим условиям.
Заказать исследования на содержание стирола в Москве можно в климатической камере – специальной установке, где моделируется среда с качественно-количественными характеристиками оцениваемого объекта.
Окисление аренов
Бензол устойчив к действию даже сильных окислителей. Но гомологи бензола окисляются под действием сильных окислителей. Бензол и его гомологи горят.
3.1. Полное окисление – горение
При горении бензола и его гомологов образуются углекислый газ и вода. Реакция горения аренов сопровождается выделением большого количества теплоты.
2C6H6 + 15O2 → 12CO2 + 6H2O + Q
Уравнение сгорания аренов в общем виде:
CnH2n–6 + (3n – 3)/2 O2 → nCO2 + (n – 3)H2O + Q
При горении ароматических углеводородов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Бензол и его гомологи горят на воздухе коптящим пламенем. Бензол и его гомологи образуют с воздухом и кислородом взрывоопасные смеси.
3.2. Окисление гомологов бензола
Гомологи бензола легко окисляются перманганатом и дихроматом калия в кислой или нейтральной среде при нагревании.
При этом происходит окисление всех связей у атома углерода, соседнего с бензольным кольцом, кроме связи этого атома углерода с бензольным кольцом.
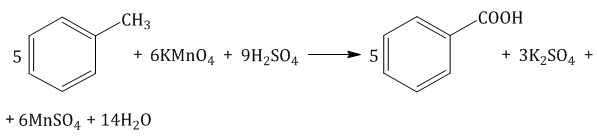
Толуол окисляется перманганатом калия в серной кислоте с образованием бензойной кислоты:
Если окисление толуола идёт в нейтральном растворе при нагревании, то образуется соль бензойной кислоты – бензоат калия:
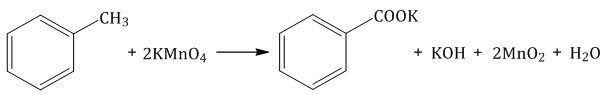
Таким образом, толуол обесцвечивает подкисленный раствор перманганата калия при нагревании.
| При окислении других гомологов бензола всегда остаётся только один атом С в виде карбоксильной группы (одной или нескольких, если заместителей несколько), а все остальные атомы углерода радикала окисляются до углекислого газа или карбоновой кислоты. |
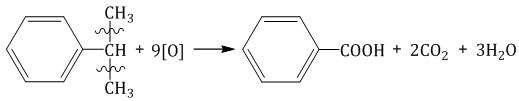
| Например, при окислении этилбензола перманганатом калия в серной кислоте образуются бензойная кислота и углекислый газ |
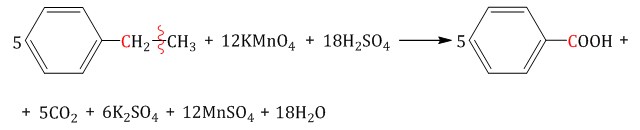
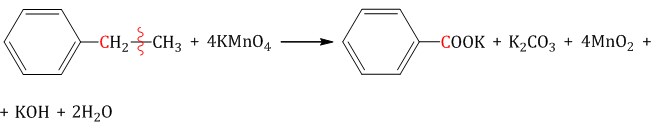
| Например, при окислении этилбензола перманганатом калия в нейтральной кислоте образуются соль бензойной кислоты и карбонат |
Более длинные радикалы окисляются до бензойной кислоты и карбоновой кислоты:
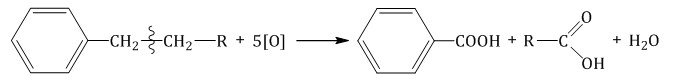
При окислении пропилбензола образуются бензойная и уксусная кислоты:
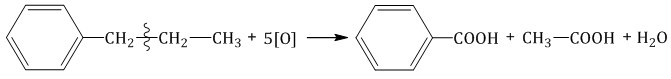
Изопропилбензол окисляется перманганатом калия в кислой среде до бензойной кислоты и углекислого газа:
Свойства
Ниже представлены основные молекулярные и физические свойства стирола.
— молекулярная масса — 104,14 атомных единиц,
— температура плавления — 30,6 градусов С,
— температура кипения — 145 градусов С,
— хорошая растворимость в большей части органических растворителей,
— растворимость в воде — 0,032 объемных процентов при температуре 20 градусов С,
— является растворителем для многих органических соединений, в том числе высокомолекулярных, например для полистирола и некоторых других полимеров,
— температура вспышки — 34,4 градуса С,
— температура воспламенения — 490 градусов С.
В смеси с водой стирол формирует азеотропную смесь, которая состоит из 66 массовых процентов стирола и имеет температуру кипения 34,8 градусов С. С солями одновалентной меди и серебром стирол образует комплексные соединения, которые часто применяют для извлечения стирола из разнообразных смесей и при очистке стирола от примесей.
Далее опишем главные химические свойства стирола.
Стирол имеет с одной стороны свойства ароматических веществ, с другой стороны свойства непредельных олефинов. Ему свойственна реакция присоединения к боковой цепи. В случае присоединения хлора или брома получаются моногалогениды или дигалогениды. Взаимодействие с бромом является количественной реакцией на стирол. При реакциях с хлороводородом, бромоводородом и циановодородом конечный продукт определяется присоединением по правилу Марковникова.
Стирол достаточно легко подвержен окислению. Исходя из состава окислителя получаются разные продукты реакции.Гидратация стирола в присутствии солей двухвалентной ртути с дальнейшей реакцией с NaBH4 ведет к получению a-фенилэтилового спирта.
Стирол характеризуется способностью к термической полимеризации, с быстрым получением полистирола. Он способен к сополимеризации с большим количеством виниловых мономеров, например с акрилонитрилом с получением АБС-пластика. Также стирол сополимеризуется с a-метилстиролом, малеиновым ангидридом с получением соответствующих сополимеров, с бутадиеном с получением бутадиенстирольного каучука и т.д.
Стирол является умеренно токсичным веществом. Его воздействие на слизистые оболочки верхних дыхательных путей приводит к их раздражению. Также стирол при попадании в организм способен вызвать головные боли, воздействовать на центральную и вегетативную нервные системы. Предельно допустимая концентрация стирола — 5 мг/куб.м.
Виды и маркировки полистирола и его сополимеров
В мире используются следующие стандартные аббревиатуры:
- PS — polystyrene, полистирол (ПС)
- GPPS — general purpose polystyrene (полистирол общего назначения, неударопрочный, блочный, иногда называемый «кристаллическим», ПСЭ, ПСС или ПСМ маркировка зависит от способа получения)
- MIPS — medium-impact polystyrene (средней ударопрочности)
- HIPS — high-impact polystyrene (ударопрочный, УПС, УПМ)
- EPS — expanded polystyrene (вспенивающийся полистирол, ПСВ)
- Аббревиатура MIPS используется сравнительно редко.
Сополимеры стирола:
- ABS — Акрилонитрил-бутадиен-стирольный сополимер (АБС-пластик, АБС-сополимер)
- ACS — Акрилонитрил-хлорэтилен-стироловый сополимер (АХС-сополимер)
- AES, A/EPDM/S — Сополимер акрилонитрила, СКЭПТ и стирола (АЭС-сополимер)
- ASA — Сополимер акрилового эфира, стирола и акрилонитрила (АСА-сополимер)
- ASR — Ударопрочный сополимер стирола (Advanced Styrene Resine))
- MABS, M-ABS — Сополимер метилметакрилата, акрилонитрила, бутадиена и стирола, прозрачный АБС
- MBS — Метилметакрилат-бутадиен-стирольный сополимер (МБС-сополимер)
- MS, SMMA — Сополимер метилметакрилата и стирола (МС)
- MSN — Сополимер метилметакрилата, стирола и акрилонитрила (МСН)
- SAM — Сополимер стирола и метилстирола (САМ)
- SAN, — AS — Сополимер стирола и акрилонитрила (САН, СН)
- SMA, S/MA — Стирол-малеиново-ангидридный сополимер
Сополимеры стирола — термопластичные эластомеры:
- ESI — Этилен-стирольный интерполимер
- SB, S/B — Стирол-бутадиеновый сополимер
- SBS, S/B/S — Стирол-бутадиен-стирольный сополимер
- SEBS, S-E/B-S — Стирол-этилен-бутилен-стирольный сополимер
- SEEPS, S-E-E/P-S — Стирол-этилен-этилен/пропилен-стирольный сополимер
- SEP — Стирол-этилен-пропиленовый сополимер
- SEPS, S-E/P-S — Стирол-этилен-пропилен-стирольный сополимер
- SIS — Стирол-изопрен-стирольный сополимер
Токсичность и охрана труда
Стирол — яд общетоксического действия. Он обладает раздражающим, мутагенным и канцерогенным эффектом. Имеет очень неприятный запах. При хронической интоксикации у рабочих бывают поражены центральная и периферическая нервные системы, система кроветворения, пищеварительный тракт, нарушается азотисто-белковый, холестериновый и липидный обмен, у женщин происходят нарушения репродуктивной функции.
Стирол проникает в организм в основном ингаляционным путём. При попадании на слизистые оболочки носа, глаз и глотки паров и аэрозоля стирол вызывает их раздражение. Содержание метаболитов бензола в моче — миндальной кислоты, фенилглиоксиновой кислоты, гинуриновой кислоты и бензойной кислоты используют в качестве экспозиционного теста.
Средняя летальная концентрация в воздухе составляет около 500—5000 мг/м³ (для крыс).
Стирол относится к третьему классу опасности (по ГОСТ 10003-90). Предельно допустимые концентрации (ПДК) стирола:
- ПДКм = 30 мг/м³;
- ПДКр.с. = 10 мг/м³ (среднесменная);
- ПДКм.р. = 0,04 мг/м³;
- ПДКс.с. = 0,002 мг/м³;
- ПДКв. = 0,02 мг/л.
Порог восприятия запаха[] может достигать 258 мг/м³, что превышает среднесменную ПДК в 25 раз.
Безопасность
Работа с применением бензола сопряжена с риском отравления и серьёзного ухудшения здоровья. Бензол — легколетучая жидкость (летучесть 320 мг/л при 20 °С) с высокой степенью воспламенения, поэтому при работе с ним необходимо соблюдать технику безопасности работ с легковоспламеняющимися жидкостями. Большую опасность представляют пары бензола, так как они могут образовывать взрывоопасные смеси с воздухом. В настоящее время применение бензола в качестве органического растворителя сильно ограничено, ввиду токсичности и канцерогенного воздействия его паров и негативном воздействии на кожу. Работа с бензолом в лабораториях также предусматривает его ограничение (строго регламентирована). Бензол рекомендуется использовать в экспериментах лишь в небольших объёмах (не более 50 мл), работа должна проводиться исключительно в перчатках из фторкаучука (латекс растворяется и набухает при воздействии на него бензолом).
Категорически запрещается:
- хранить вблизи источников тепла, открытого огня, сильных окислителей, пищевых продуктов, и так далее,
- оставлять в открытом виде тару, содержащую бензол, курить,
- использовать тару из-под бензола для пищевого применения, мытья рук, посуды,
- производить работу в закрытом, плохо вентилируемом помещении с температурой воздуха больше 30°С,
- использовать большой объём вещества в качестве растворителя,
- работать без средств защиты кожи рук, глаз и органов дыхания.
ПДК в воздухе составляет 5 мг/м3 (среднесменная за 8 часов).
Охрана труда
В России ПДК бензола в воздухе рабочей зоны установлена равной 5 мг/м3 (среднесменная за 8 часов) и 15 мг/м3 (максимально-разовая). Однако по данным ряда исследований, порог восприятия запаха этого вещества может быть гораздо выше ПДКрз. Например, среднее значение порога в исследовании было в ~ 100 раз выше среднесменной ПДКрз, и в ~ 30 раз выше максимально-разовой ПДКрз. А у части людей порог был значительно выше среднего значения. Поэтому можно ожидать, что использование широко распространённых в сочетании с «заменой по появлении запаха под маской» (как это почти всегда рекомендуется в РФ поставщиками СИЗОД) приведёт к чрезмерному воздействию паров бензола на, по крайней мере, часть работников — из-за запоздалой замены противогазных фильтров. Для защиты от бензола следует использовать значительно более эффективные изменение технологии и средства коллективной защиты.