Полимеры. общие сведения
Содержание:
- Свойства
- Полимеры и мономеры органических молекул
- Применение
- Органические молекулы и особенности их углеродных цепочек
- Высокомолекулярные соединения: историческая справка
- Что это такое?
- Преимущества и недостатки
- Сферы применения
- Свойства
- Свойства и характеристики материала
- Органичесие молекулы и функциональные группы
- Изомерия органических молекул
Свойства
Полимерам присущ комплекс специфических физ.-хим. и механических свойств: способность к образованию высокопрочных анизотропных высокоориентированных волокон и пленок, способность проявлять большие и длительно развивающиеся обратимые деформации, характеризующиеся малыми значениями модуля упругости; способность к набуханию перед растворением и высокая вязкость растворов.
Этот комплекс свойств обусловлен высоким мол. весом (массой), цепным строением и гибкостью, т. е. способностью менять свою форму при сохранении всех хим. связей линейных макромолекул. При переходе от линейных цепей к разветвленным редким трехмерным сеткам и далее к густым сетчатым структурам эти свойства становятся все менее выраженными. Сильно «сшитые» В. с. нерастворимы, неплавки и не способны к высокоэластическим деформациям.
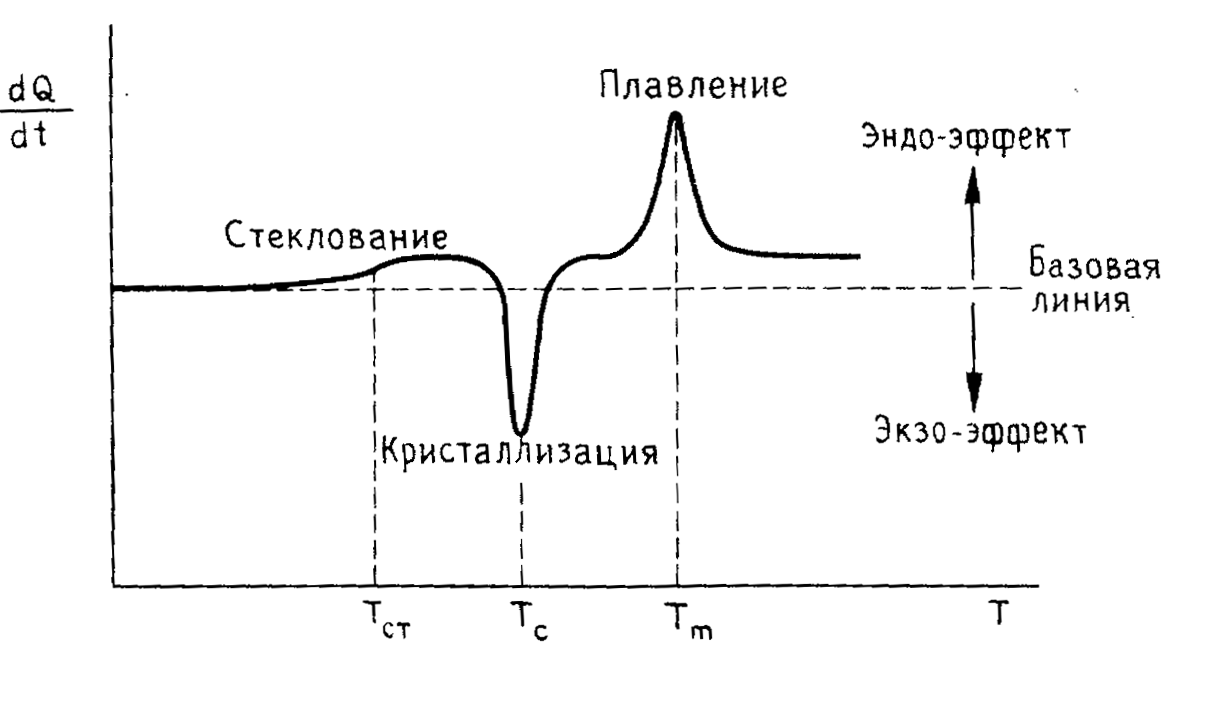
В. с. существуют в кристаллическом и аморфном состояниях. Необходимое условие кристаллизации — регулярность достаточно длинных участков макромолекулярной цепи. В кристаллических полимерах возможно возникновение разнообразных кристаллических форм (фибрилл, сферолитов, монокристаллов и др.), тип к-рых определяет свойства полимерного материала. Незакристаллизованные полимеры могут находиться в трех физ. состояниях: стеклообразном, высокоэластическом и вязкотекучем.
В. с. могут вступать в следующие разнообразные хим. реакции: 1) образование хим. связей между макромолекулами (так наз. сшивание), напр, вулканизация каучуков, дубление кожи; 2) распад макромолекулярных цепей на отдельные, более короткие фрагменты (деструкция); 3) реакции боковых функциональных групп с низкомолекулярными веществами, не затрагивающие основную цепь (так наз. полимераналогичные превращения в цепях); 4) внутримолекулярные реакции, протекающие между функциональными группами одной макромолекулы, напр, внутримолекулярная циклизация. Когда имеют место превращения с участием функциональных групп (звеньев) макромолекул, полимерное состояние В. с. влияет на кинетику и термодинамику реакций и хим. строение образующихся продуктов. Реакционная способность функциональной группы (или отдельного звена, связанного с В. с.) по сравнению с реакционной способностью низкомолекулярного аналога этого звена определяется следующими эффектами: 1) эффект полимерной цепи, напр, за счет электронного влияния; 2) эффект концентрационный — за счет изменения микроконцентрации реагентов вблизи макромолекулы; 3) электростатический эффект, напр, в полимерах, содержащих заряженные звенья (полиэлектролиты); 4) эффект конфигурационный, напр, в случае стереорегулярных полимеров; 5) эффект формы макромолекул в растворе, когда, напр., переход глобулярной формы белка-фермента в фибриллярную изменяет скорость каталитической реакции в миллион и более раз; 6) эффект надмолекулярной организации — из-за высокой склонности макромолекул к агрегации и к структурированию даже в разбавленных растворах.
Нек-рые свойства В. с., напр, растворимость, способность к вязкому течению, стабильность и т. д., очень чувствительны к действию небольших количеств примесей или добавок, реагирующих с макромолекулами. Так, чтобы превратить линейный полимер из растворимого в нерастворимый, достаточно образования 1—2 поперечных связей на одну макромолекулу.
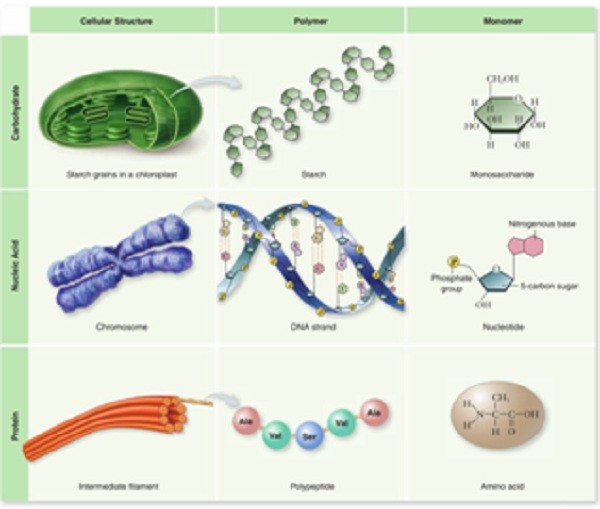
Полимеры и мономеры органических молекул
В большинстве случаев органические макромолекулы являются полимерами. Полимер — это длинная молекула, построенная из объединения большого количества небольших похожих субъединиц, называемых мономерами. В упрощённом виде они похожи на железнодорожные вагоны, соединённые в поезд. Характер полимера определяется мономерами, используемыми для его построения. Вот несколько примеров полимеров и их мономеров.
- Сложные углеводы, такие как крахмал, состоят из простых кольцеобразных сахаров.
- Мономерами нуклеиновых кислот (ДНК и РНК) являются нуклеотиды.
- Белки построены из аминокислот.
Липиды тоже макромолекулы, но они не соответствуют соотношению мономер — полимер. Липиды сформированы через реакции дегидратации, которые связывают жирные кислоты с глицерином. Макромолекулы образуются в результате химической реакции дегидратации и разрушаются гидролизом.
 Полимеры и мономеры органических молекул
Полимеры и мономеры органических молекул
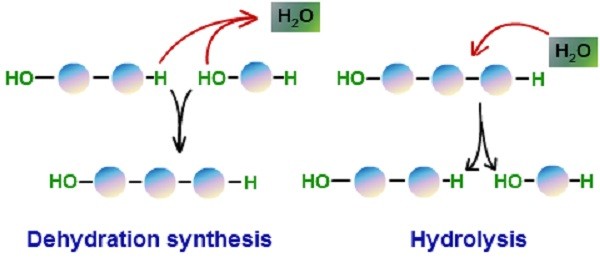
Реакции присоединения (дегидратации)
Несмотря на различия между мономерами основных органических полимеров, химия их синтеза аналогична. При образовании ковалентной связи между двумя мономерами с одной стороны отрывается гидроксильная группа OH, с другой атом водорода, а вместе получается молекула воды Н2О.
Эта реакция характерна для присоединения нуклеотидов в молекуле ДНК и соединения молекул глюкозы, для получения крахмала. Она также используется для связывания жирных кислот и глицерина в молекулах липидов. Этот процесс называется также реакцией дегидрации, катализа или обезвоживания. Катализ осуществляется в клетке при участии ферментов.
Органические молекулы и реакция гидролиза
При разрыве мономеров происходит обратная реакция гидролиза с добавлением молекулы воды. В этой реакции атом водорода присоединяется к одной группе, а гидроксильная группа разрывает ковалентные связи. Когда вы едите картофель, ваш организм разрушает крахмал до глюкозы путём гидролиза.
|
Макромолекулы |
|||
| Название макромолекулы | Из чего состоит | Пример | Функции |
|
Полисахариды |
|||
| 1. Крахмал
2. Гликоген |
Глюкоза | 1. Запасное вещество растительных клеток.
2. Клетки печени животных, клетки грибов. |
Хранение энергии. |
| Целлюлоза | Глюкоза | Сельдерей, сахарная свёкла и другие растения. | Опорная, в клеточной стенке растений. |
| Хитин | Модифицированная глюкоза | Покровы насекомых, клеточная стенка грибов. | Структурная, опорная. |
|
Нуклеиновые кислоты |
|||
| ДНК | Нуклеотид. | Хромосомы. | Кодирует гены. |
| РНК | Нуклеотид. | Матричная РНК (мРНК). | Необходим для экспрессии генов. |
|
Протеины (белки) |
|||
| Ферменты | Аминокислоты | Клетки | Катализ |
| Коллаген | Аминокислоты | Волосы, кожа, шёлк | Структурная |
|
Липиды |
|||
| Триглицериды (животные жиры, масла) | Глицерин и 3 жирные кислоты | Масло сливочное, кукурузное масло, мыло | Хранение энергии |
| Фосфолипиды | Глицерин, 2 жирные кислоты, фосфат и полярные R-группы | Фосфатидилхолин | Клеточная мембрана |
| Простагландины | Пятиуглеродные кольца с двумя неполярными хвостами | Рецепторы | Химические медиаторы |
| Стероиды | Четыре конденсированных углеродных кольца | Эстроген, холестерин | Гормональная, структурная – входит в состав мембран |
| Терпены | Длинные углеродные цепи | Каротин, каучук, хвойные растения | Часть пигментов, структурная |
Применение
Механическая прочность, эластичность, электроизоляционные и другие ценные свойства обусловили широкое применение В. с. в различных отраслях промышленности и в быту. Основные типы полимерных материалов — каучуки и резины, волокна, пластмассы, пленки, лаки, эмали, краски и клеи.
Установлены следующие требования, к-рым должны удовлетворять В. с., используемые в мед. целях: 1) чистота продукта; 2) возможность формовки в требуемое изделие без разложения полимера и каких-либо вредных изменений; 3) наличие необходимых хим., физ. и механических свойств для выполнения требуемых функций; 4) постоянство формы и свойств при стерилизации; 5) физ., хим. и механическая устойчивость при взаимодействии с окружающей биол, средой; 6) отсутствие токсикологических, пирогенных и канцерогенных свойств при контакте с организмом. Так, полимерный материал в контакте с кровью не должен вызывать тромбообразования и не влиять на нормальный механизм свертывания крови; не изменять конфигурацию или стабильность любой клетки или растворимой части крови, что могло бы привести к различным патологическим последствиям. Следует учитывать, что в живом организме под действием биол, среды могут происходить изменения физ. и хим. характеристик полимерных цепей, напр, гибкости вследствие минерализации, хим. деградации и т. д.
Синтетические и природные В. с. применяются для изготовления полунепроницаемых мембран, используемых в аппаратах «искусственное легкое» и «искусственная почка». В этом случае В. с. должны удовлетворять всем перечисленным выше требованиям, кроме того, обладать способностью набухать в воде и разделительной способностью. Мембраны для гемодиализа можно изготавливать из целлофана, получаемого из целлюлозы, сополимеров полиэтиленгликоля с полиэтилентерефталатом, сшитого поливинилпирролидона, полимер-полимерных комплексов — из полиэлектролитов противоположного знака заряда (напр., комплекс полистиролсульфоната натрия и поливинилбензилтриметиламмоний хлорида). Материалом для оксигенаторных мембран, обеспечивающих насыщение крови кислородом и удаление углекислого газа, служит, напр., полидиметилсилоксан.
Синтетические и природные В. с. применяют и в фармакологии (гепарин, крахмал, пепсин, глобулины, протамины и декстраны различного мол. веса, вводимые в кровяное русло). Поливинилпирролидон и полиглюкин используют как заменители плазмы крови, а первый, кроме того, как активный дезинтоксикатор ядов и токсических веществ, накапливающихся в организме. Комплексное соединение поливинилпирролидона с йодом, так же как и йодинол (комплекс поливинилового спирта с йодом), является эффективным бактерицидом и фунгицидом. Основу мазей составляют различные нетоксичные силиконовые полимеры, обладающие гидрофобными свойствами (см. Гидрофобные вещества). В основу мазей, таблеток или покрытий лекарств часто входит полимерный компонент — полиэтиленоксид.
Синтетические полимеры могут обладать и собственной физиол, активностью. Так, поли-N-окси-2-винил-пиридин используют для лечения силикоза, полимерные четвертичные аммониевые соли из тетраметилгексаметилендиамида и триметилендибромида используют для связывания в организме избыточного гепарина. В. с., если они несут на себе фармакологически активную молекулу или группу, могут пролонгировать действие лекарственных веществ. Кроме того, макромолекулы В. с. могут служить депо лекарственных препаратов, способствуя постепенному выделению их в организм. Такие комбинации В. с. с лекарственными препаратами получают либо полимеризацией мономеров, имеющих двойную связь и содержащих лекарственный фрагмент (напр., акрилоилновокаин), либо методом полимераналогичных превращений с водорастворимыми полимерами (напр., поливиниловый спирт, поливинил-пиридин, декстраны и др.).
См. также Полимерные материалы.
Библиогр.: Лосев И. П. и Tростянская Е. Б. Химия синтетических полимеров, М., 19 71; Полимеры в медицине, пер. с англ., под ред. Н. А. Платэ, М., 1969; Рабинович И. М. Применение полимеров в медицине, Л., 1972, библиогр.; Сидельковская Ф. П. Химия N-винилпирролидона и его полимеров, М., 1970; Стреиихеев A. А., Деревицкая В. А. и Слонимский Г. Л. Основы химии высокомолекулярных соединений, М., 1966; Ушаков С. Н. Синтетические полимеры лекарственного назначения, Л., 1962.
Органические молекулы и особенности их углеродных цепочек
Биологические системы подчиняются всем законам химии. Каркас органических молекул состоит из атомов углерода, связанных с атомами кислорода, азота, серы, фосфора и водорода. Поскольку атом углерода может образовывать до 4 ковалентных связей, молекулы, содержащие углерод могут образовывать разные цепи:
- прямые,
- ветвистые,
- кольцеобразные,
- шарообразные,
- в виде трубок,
- катушек.
Органические молекулы, состоящие только из углерода и водорода, называются углеводородами. Так как углеводородные ковалентные связи хранят значительное количество энергии, углеводороды являются хорошим топливом. Это, например, газ пропан, состоящий из цепи из трёх атомов углерода, связанных с восьмью атомами водорода: C3H8.
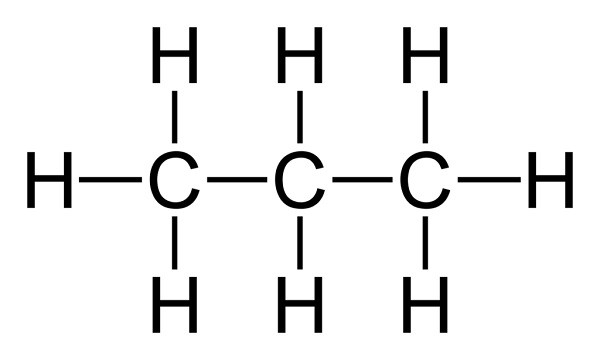 Структурная формула пропана
Структурная формула пропана
Теоретически длина углеродных цепочек может быть неограниченной.
Высокомолекулярные соединения: историческая справка
Термин «полимерия» введен в науку Й.Берцелиусом в 1833 для обозначения особого вида изомерии, при которой вещества одинакового состава имеют различную молекулярную массу, например этилен и бутилен, кислород и озон (таким образом, содержание термина не соответствовало современным представлениям о полимерах).
Ряд высокомолекулярных соединений был получен, по-видимому, еще в 1-й половине 19 в. Однако в то время их рассматривали как нежелательные побочные продукты «осмоления». Первые упоминания о синтетических высокомолекулярных соединениях относятся к 1838 (поливинилхлорид) и 1839 (полистирол).
До конца 20-х гг. 20 в. наука о высокомолекулярных соединениях развивалась главным образом в русле интенсивного поиска способов синтеза каучука (Г.Бушарда, У.Тилден, И.Л.Кондаков, С.В.Лебедев. и др.). В 30-х гг. было доказано существование свободнорадикального (Г.Штаудингер и др.) и ионного (Ф.Уитмор и др.) механизмов полимеризации. Большую роль в развитии представлений о поликонденсации сыграли работы У.Карозерса, который ввел в химию высокомолекулярных соединений понятия функциональности мономера, линейной и трехмерной поликонденсации. Он же в 1931 синтезировал совместно с Дж.А.Ньюландом хлоропреновый каучук (неопрен) и в 1937 разработал метод получения полиамида для формования волокна типа найлон.
Автором принципиально новых представлений о высокомолекулярных соединениях как о веществах, построенных из макромолекул, был Штаудингер. Победа его идей (к нач. 40-х гг. 20 в.) привела к тому, что высокомолекулярные соединения стали рассматривать как качественно новый объект исследования химии и физики. В 40-60-х гг. значительный вклад в исследование закономерностей поликонденсации, теорию растворов высокомолекулярных соединений и статистическую механику макромолекул внес П.Флори.
Развитие химии и физики высокомолекулярных соединений в СССР связано с именами: С.С.Медведева, который в 30-х гг. впервые установил свободнорадикальную природу активных центров роста цепи при инициировании полимеризации пероксидами и сформулировал понятие передачи цепи; А.П.Александрова, впервые развившего в 30-х гг. представления о релаксационной природе деформации полимерных тел; В.А.Каргина, установившего в конце 30-х гг. факт термодинамической обратимости растворов полимеров и сформулировавшего систему представлений о трех физических состояниях аморфных высокомолекулярных соединений; К.А.Андрианова, впервые синтезировавшего в 1937 полиорганосилоксаны, и др.
Лит.: Энциклопедия полимеров, т. 1-3, М., 1972-77; Стрепихеев А.А., Деревицкая В.А., Основы химии высокомолекулярных соединений, 3 изд., М., 1976; Ван Кревелен Д.В., Свойства и химическое строение полимеров, пер. с англ., М., 1976; Шур A.M., Высокомолекулярные соединения, 3 изд., М., 1981; Encyclopedia of polymer science and technology, v. 1-16, N. Y.-[a.o.j, 1964-72, Suppl. v. 1-2, 1976-77.
B.A. Кабанов.
Что это такое?
Этот материал относят к одному из видов пластичного полимеризованного этилена. Его особенность – удлиненные линейные молекулярные связи, ориентированные в одном и том же направлении. Такие цепи отличаются лучшим восприятием и передачей нагрузок.
По внешнему виду высокомолекулярный полиэтилен напоминает пластик. Он твердый, без запаха, в его составе отсутствуют токсичные вещества. Материал производится методом синтеза этилена и металлоценовых катализирующих веществ на установках низкого давления. На стадии производства в сырье добавляют колер для придания полимеризованному этилену окраса.
Производители также выпускают сверхвысокомолекулярный (ультравысокомолекулярный) полимер с молекулярной массой более 10000000 ед. (PE-1000). По прочностным характеристикам он в несколько раз превосходит некоторые марки углеродистых и нержавеющих сталей.
Преимущества и недостатки
Материал обладает рядом весомых достоинств. Основные преимущества заключаются в следующем:
- отличная сопротивляемость износу и механическим истираниям; полимер с высокой плотностью имеет высокую ударную прочность;
- стойкость к образованию трещин, сколов и других видов деформаций;
- устойчивость к колебаниям температур, благодаря чему материал допускается эксплуатировать как при чрезмерно высоких, так и при минимальных температурных показателях;
- стойкость к воздействию влаги и агрессивных веществ (кроме окислителей); такая особенность достигается благодаря отсутствию в составе материала амидов, сложных эфиров или гидроксильных групп, отличающихся восприимчивостью к химически-агрессивным веществам;
- устойчивость к солнечному излучению;
- высокие гигиенические свойства – материал не подвержен атакам патогенных микроорганизмов; на нем не образуются грибок и плесень;
- хорошая электроизоляционная и диэлектрическая способность;
- у полиэтилена PE-500 отличная свариваемость;
- стойкость к радиационному воздействию.
Высокомолекулярный полиэтилен относительно нов. Его производством занимаются 2 отечественных предприятия («Томскнефтехим» и «Казаньоргсинтез»). Технология изготовления сложна и финансово затратна, что сказывается на стоимости готовой продукции.
Сферы применения
Благодаря уникальным свойствам высокомолекулярный полиэтилен используют в различных сферах. Его нередко применяют как аналог, заменяющий различные цветные металлы, высоколегированные стали и другие материалы.
В медицине
Сверхпрочный полимер применяется для изготовления имплантов с 1962 года. Сегодня из него делают протезы для тазобедренных суставов в хирургии и зубных имплантов в стоматологии. Материал применяется для создания различных ортопедических товаров.
В химической, пищевой и легкой промышленности
Материал используется для изготовления оборудования и комплектующих для пищевого производства, емкостей для хранения и транспортировки химически-агрессивных веществ, флаконов для косметики, бочек, цистерн.
В военной отрасли
Прочные волокна полимера применяются для изготовления средств индивидуальной защиты для сотрудников спецслужб. В частности из них изготавливают бронежилеты, каски. Полученная броня имеет небольшой вес, но при этом она надежно защищает от пулевых ранений. А также при помощи этого полимера бронируют спецтехнику.
В машиностроении
Высокопрочный полиэтилен используется для изготовления запчастей, работающих в гидравлических или масляных средах. Из него производят подшипники, втулки, вкладыши, шестерни – детали, подверженные высокой степени механического истирания. Из сверхпрочного полимера PE-1000 изготавливают запчасти для пневмоустановок с повышенным рабочим давлением.
Спортивные товары и инвентарь
Материал используется при изготовлении костюмов для фехтования, альпинистского обмундирования, лыж, сноубордов.
Из высокопрочного полимера изготавливаются многочисленные товары народного потребления. К ним относят изделия для цветоводства и обустройства ванной комнаты, предметы домашнего обихода и садово-огородный инвентарь. Он применяется для производства мебели, детских игрушек, мобильных туалетов, инвентаря для обустройства детских игровых комплексов.
Ещё больше полезной информации о высокомолекулярном полиэтилене можно узнать из видео.
Свойства
В связи со строением молекул СВМПЭ является термопластичным веществом с относительно невысокой температурой плавления (135—190 °С), поэтому изделия из СВМПЭ не рекомендуется эксплуатировать при температурах превышающих 80—100 °С. При нагревании выше температуры плавления СВМПЭ не переходит в вязкотекущее состояние, а лишь в высокопластичное. Поверхность изделий из СВМПЭ — гладкая на ощупь.
СВМПЭ обладает очень низким для органических полимерных соединений водопоглощением, в пределах 0,01—0,05 %, что обусловлено отсутствием в молекулах СВМПЭ полярных групп (сложноэфирных, амидных, гидроксильных группировок). Поэтому свойства СВМПЭ не изменяются при воздействии воды (для сравнения, у кевлара прочность при намокании уменьшается в 2 раза из-за нарушения слабых водородных связей амидных групп, при высыхании прочность восстанавливается не полностью). СВМПЭ также устойчивы к воздействию большинства кислот и щелочей, ультрафиолетового и гамма излучения и микроорганизмов.
Удельная плотность чистого СВМПЭ — примерно 0,93—0,94,г/см³ с добавками — 0,95 г/см³. Отношение предела прочности на разрыв к массе у СВМПЭ на 40 % больше, чем у арамидных соединений типа кевлара. При наличии долговременной статической нагрузки, действующей на растягивание, СВМПЭ деформируется пока существует механическое напряжение (такое свойство называется ползучестью).
СВМПЭ имеет достаточно высокий модуль упругости при изгибе — около 1 ГПа и разрушающее растягивающее или изгибное напряжение 20—40 МПа (~4 кгс/мм²), уступая, таким образом, по разрушающим напряжениям лучшим высоколегированным малоуглеродистым высокочистым сталям в 50—100 раз, а по модулю упругости — в 200 раз (например, инструментальная сталь 4Х5МФС после низкотемпературной термомеханической обработки или аусформинга имеет напряжение разрушения σb≈250 кгс/мм² и предел текучести σ0,2≈180—230 кгс/мм²). Однако благодаря низкой плотности, в 8—8,5 раз меньшей, чем у сталей, и высокой усталостной прочности (выносливости), изделия из СВМПЭ могут конкурировать по показателю прочность/собственный вес с изделиями из низкопрочных конструкционных сталей и даже превосходить их.
Основные свойства СВМПЭ, обуславливающие его применение, — очень высокая износостойкость, низкий коэффициент трения и высокая вязкость разрушения (низкотемпературная надёжность). Так, по износостойкости СВМПЭ при допустимых для него температурах эксплуатации и некоторых абразивах превосходит тефлоны и даже углеродистые стали. Коэффициент трения СВМПЭ (по стали) — около 0,1. Коэффициент ударной вязкости — 170 кДж/м² (с надрезом — до 80 кДж/м²), рабочие температуры — от минус 150 °С или даже минус 260 °С (по другим данным — от минус 80 °С) до плюс 80—90 °С.
Свойства и характеристики материала
Высокопрочный полиэтилен имеет длинные молекулярные цепи, расположенные практически параллельно относительно друг друга. Такая особенность строения обеспечивает высокие прочностные показатели. Однако между некоторыми молекулами возникают слабые связи, из-за чего материал нельзя назвать теплостойким. Его рабочие температуры – до +100°С. При повышении температурных показателей до +140 градусов полимер плавится и превращается в вязкую массу.
Полимер PE-1000 имеет следующие технические характеристики:
- водопоглощение – 0,01-0,05%;
- удельная плотность – 0,93-0,94 г/см³;
- модуль упругости при изгибе – не более 1 ГПа;
- коэффициент трения – около 0,1;
- коэффициент ударной вязкости – 160-170 кДж/м²;
- удлинение при изгибе – 8-10%;
- поверхностное сопротивление – 1014 Ом.
Органичесие молекулы и функциональные группы
Атомы углерода и водорода обладают очень похожими электронными свойствами. Поэтому их связи распределены равномерно без разницы во влиянии над молекулярной поверхностью. По этой причине углеводороды неполярны. Многие органические вещества содержат полярные группировки. Поскольку эти группировки существенно более реакционноспособны по сравнению с углеводородными цепями, они носят название функциональных групп.
Функциональные группы имеют определённые химические свойства, которые они сохраняют в любой ситуации. Например, гидроксильная (OH) и кислотная карбоксильная (COOH) группы полярны из-за электроотрицательности атомов кислорода. Другие общие функциональные группы: фосфатная (PO4 –), которая при отщеплении даёт большое количество энергии и основная аминная (NH2). Многие их них могут образовывать водородные связи. Доноров и акцепторов водородной связи можно опознать по деятельности их электронов.
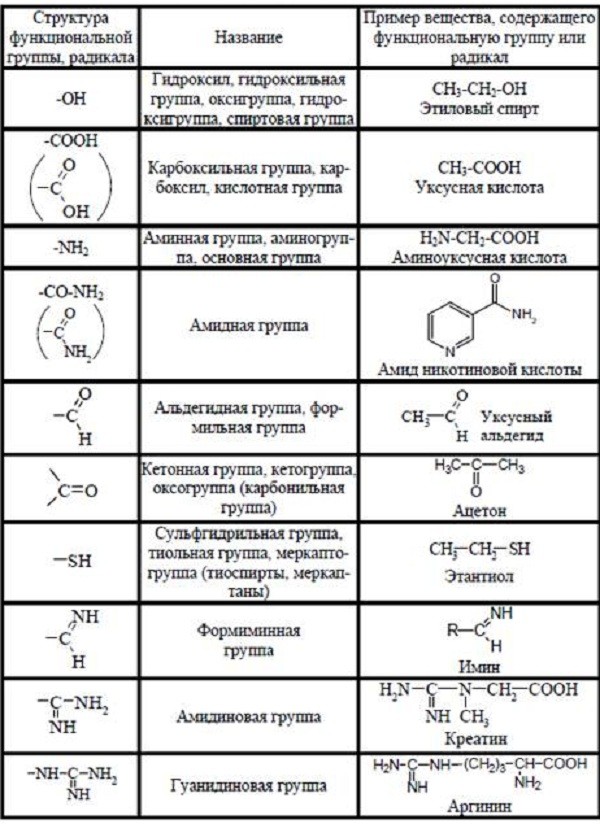 Важные функциональные группы и радикалы
Важные функциональные группы и радикалы
Изомерия органических молекул
Органические молекулы, имеющие одну и ту же молекулярную формулу, могут существовать в разных формах, называемых изомерами.
- При различие в структуре их углеродного скелета (порядке соединения атомов) они называются структурными изомерами. Например, глюкоза и фруктоза — структурные изомеры с формулой C6H12O6.
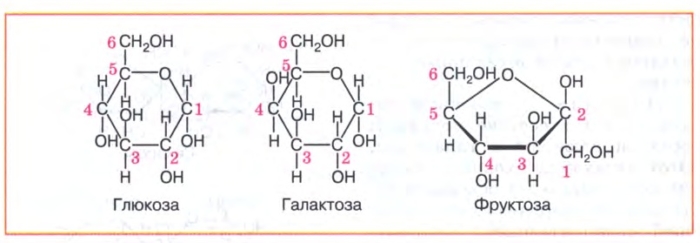
- Другая форма изомерии называется стериоизомерией, молекулы имеют тот же углеродный скелет, но отличаются расположением (ориентацией) прикрепления к нему групп в пространстве. Ферменты биологических систем распознают только один специфический стериоизомер.
- Молекула, которая имеет зеркальные версии, называется хиральной. Хиральность характеризуется наличием структур, которые нельзя совместить, поскольку они являются зеркальным отображением друг друга. Наиболее частое возникновение зеркальных свойств — наличие асимметричного атома углерода.
Хиральные соединения характеризуются влиянием на поляризованный свет. Поляризованный свет имеет одну плоскость, которую хиральные молекулы поворачивают вправо или влево. В этом случае образуется две формы изомеров с различной конфигурацией (энантиомеры — подкатегрия стериоизомеров). Чаще всего энантиомеры носят названия L и D-форм. Живые системы имеют тенденцию производить только один энантиомер из двух возможных форм; например, в большинстве организмов мы находим в основном D-сахара и L-аминокислоты. Молочная кислота существует в двух формах:
- правовращающая L-молочная кислота концентрируется в мышцах и крови животных;
- D-молочная кислота продуцируется микроорганизмами и может быть обнаружена например в молочных продуктах.