Молекулярная физика. размеры, масса молекул
Содержание:
- Средняя молекулярная масса — продукт
- Точность и неуверенность
- Средневязкостная молекулярная масса
- Методики определения молекулярной массы
- Структура, свойства и применение радиационных регенераторов резин на основе бутилкаучука моногррафия
- Газы и пары.
- Объемы газов
- СТРУКТУРА ХРОМОГЕННЫХ КОРПУСКУЛ АЗУЛЕНА [Электронный ресурс] / Михеев, Гусева, Заиков // Известия высших учебных заведений. Химия и химическая технология .— 2012 .— №5 .— С. 1-15 .— Режим доступа: https://rucont.ru/efd/421739
- Высокомолекулярные соединения. Ч. 1 метод. указания
- Средняя молярная масса
- ОБНАРУЖЕНИЕ И ОПРЕДЕЛЕНИЕ АГРЕГАТОВ ХИТОЗАНА КАПИЛЛЯРНЫМ ЗОННЫМ ЭЛЕКТРОФОРЕЗОМ С ПРИМЕНЕНИЕМ ДАВЛЕНИЯ [Электронный ресурс] / Джераян [и др.] // Журнал аналитической химии .— 2017 .— №3 .— С. 67-73 .— Режим доступа: https://rucont.ru/efd/583625
- Измерение
- Задачи на количество вещества
- Похожие:
- Расчет объема 1 моля газа
- Итоги
Средняя молекулярная масса — продукт
Средняя молекулярная масса продукта при получении полиамидов из диаминов и дикарбоновых кислот зависит от соотношения исходных веществ. Соль АГ представляет собой белый кристаллический порошок ( т; пл. С), легко растворимый в воде.
Средняя молекулярная масса продукта растет при понижении температуры и повышении давления. При понижении температуры уменьшается также степень раз-ветвленности макромолекул.
Среднюю молекулярную массу продуктов конденсации димети-лолметиленмочевины определяют так же с учетом молярного отношения.
Зная среднюю молекулярную массу продукта ( Мср), по величине бромного или йодного числа подсчитывают количество непредельных углеводородов N ( мас.
|
Химический состав продуктов разложения ПТФЭ-4 ( а и полиэтилена ( б в случае термохимического равновесия. |
Видно, что средняя молекулярная масса продуктов деструкции политетрафторэтилена во всем рассмотренном диапазоне давлений ре превышает 100 и быстро возрастает с увеличением давления.
Уравнения системы позволяют учесть изменения с температурой теплоемкостей и средней молекулярной массы продуктов сгорания, зависящих от степени диссоциации.
Из одной молекулы большого размера образуются два более низкомолекулярных устойчивых продукта, что приводит к снижению средней молекулярной массы продуктов реакции.
Из соотношения (1.17) следует, что удельный импульс прямо пропорционален квадратному корню из температуры в камере сгорания и обратно пропорционален квадратному корню из средней молекулярной массы продуктов сгорания, поэтому величина ( ГК / М) 1 / 2 является хорошей характеристикой эффективности топлив при их сравнении.
Из соотношения (1.17) следует, что удельный импульс прямо пропорционален квадратному корню из температуры в камере сгорания и обратно пропорционален квадратному корню из средней молекулярной массы продуктов сгорания, поэтому величина ( ГК / М) 1 / 2 является хорошей характеристикой эффективности топлив при их сравнении.
Реакция ускоряется при использовании уксусной кислоты в качестве катализатора. Средняя молекулярная масса продукта увеличивается при повышении давления. При температуре около 250 С реакция идет практически до конца, и при достижении равновесия образуется полимер, содержащий менее 1 % мономера и низкомолекулярных соединений.
Сложнее обстоит дело с зависимостью средней молекулярной массы продукта от соотношения скоростей диффузии и полимеризации.
Численное решение системы (6.33) — (6.35) дает искомые характеристики детонационной волны: D, ez и Tz. Уравнения системы позволяют учесть изменения с температурой теплоемкостей и средней молекулярной массы продуктов сгорания, зависящих от степени диссоциации.
Неоднородность полимера по размерам макромолекул характеризует его полидисперсность. Поэтому, когда говорят о молекулярной массе, имеют в виду среднюю молекулярную массу продукта. В настоящее время промышленность использует для синтеза высокомолекулярных соединений следующие основные методы: цепную полимеризацию, ступенчатую полимеризацию, превращение циклов в линейные полимеры и поликонденсацию.
Примесь инертных и других газов, не участвующих в химической реакции, существенно влияет на скорость детонации газовой смеси. Это влияние связано с тем, что скорость детонации обратно пропорциональна корню квадратному из средней молекулярной массы продуктов детонации ( гл. Поэтому при добавлении, в некоторых пределах, к газовой взрывчатой смеси компонента, уменьшающего средний молекулярный вес продуктов взрыва, несмотря на некоторое снижение температуры в зоне химической реакции, скорость детонации возрастает.
Точность и неуверенность
Точность, которой известна молярная масса, зависит от точности атомных масс, от которых это было вычислено. Большинство атомных масс известно точности по крайней мере одной части в десять тысяч, часто намного лучше (атомная масса лития известное, и серьезное, исключение). Это достаточно для почти всей нормальной эксплуатации в химии: это более точно, чем большинство химических исследований и превышает чистоту большинства лабораторных реактивов.
Точность атомных масс, и следовательно молярных масс, ограничена знанием изотопического распределения элемента. Если более точная ценность молярной массы требуется, необходимо определить изотопическое распределение рассматриваемого образца, который может отличаться от стандартного распределения, используемого, чтобы вычислить стандартную атомную массу. Изотопические распределения различных элементов в образце не обязательно независимы от друг друга: например, образец, который был дистиллирован, будет обогащен в более легких изотопах всех существующих элементов. Это усложняет вычисление стандартной неуверенности в молярной массе.
Полезное соглашение для нормальной лабораторной работы состоит в том, чтобы указать молярные массы к двум десятичным разрядам для всех вычислений. Это более точно, чем обычно требуется, но избегает округлять ошибки во время вычислений. Когда молярная масса больше, чем 1 000 г/молекулярных масс, редко уместно использовать больше чем один десятичный разряд. Эти соглашения сопровождаются в наиболее сведенных в таблицу ценностях молярных масс.
Средневязкостная молекулярная масса
Для образцов СКИ, полученного с титановым катализатором, отсутствует корреляция между показателями пластичности и вязкости по Муни и средневязкостной молекулярной массой; для золь-фракции указанные зависимости имеют обычный вид: вязкость по Муни возрастает, а пластичность уменьшается при увеличении значения характеристической вязкости.
Следует подчеркнуть, что для двух указанных участков кривой долговечности характерны разные механизмы разрушения, так как для них наблюдаются разные величины инкубационного периода роста трещин, кажущейся энергии активации, кроме того, они отличаются характером трещинообразования и зависимостью долговечность — средневязкостная молекулярная масса. Изменение молекулярной массы в результате протекания процессов разрушения и данные по долговечности этих образцов ( см. табл. 7.5) позволяют определить среднюю скорость изменения молекулярной массы в области крутого и пологого участков изотермы длительной прочности. Скорость уменьшения молекулярной массы оценивалась как v ( M v — Му) / М у (, где M v — молекулярная масса до нагружения полимера; Mv — молекулярная масса после разрушения полимера; ( — долговечность полимера, мин. Таким образом, данные о разрушении на молекулярном уровне также свидетельствуют о разных механизмах разрушения полиэтилена на рассмотренных участках кривой долговечности.
Зависимость lg TJ / TJO от lg ( y rj0 / G0), где G0 Gon ( Mw / Mn) ] — 015 с учетом полидисперсности приведена на рис. 6.1, при этом следует иметь в виду, что TJO зависит только от средневязкостной молекулярной массы БК, но не зависит от ММР.
Поэтому иногда средневязкостную молекулярную массу называют среднегидродинамической.
|
Значения и0 уд, ky и z для полимеризации ВА, адсорбированного на АС / 400, на различных стадиях реакции ( исходное заполнение 0 7 ммоль / г, 20 С. |
На рис. 3.26 приведены соответствующие данные, рассчитанные по средневязкостным молекулярным массам.
Поскольку любой полимер представляет собой смесь молекул с различной молекулярной массой, найденная тем или иным способом молекулярная масса полимера является некоторой средней величиной, значение которой будет зависеть от принципа, положенного в основу метода ее определения. Из многих типов средних молекулярных масс на практике чаще всего определяют среднечисловую, сред-невесовую, г-среднюю и средневязкостную молекулярную массу.
Эбулиоскопический и изопиестический методы определения молекулярной массы дают возможность установить среднечис-ленную молекулярную массу олигомеров и полимеров, так как основаны на свойстве, связанном с числом частиц в растворе. Методы эти являются абсолютными, поскольку не требуют предварительного установления связи исследуемого свойства раствора и размеров макромолекул, как, например, при определении средневязкостной молекулярной массы.
Значение Mw всегда больше, чем Мп; наличие в полимере фракций с различной молекулярной массой может быть охарактеризовано коэффициентом полидисперсности Mv / Mn. Измерение вязкости растворов полимеров позволяет определить так называемую средневязкостную молекулярную массу Mv. Значение Afv занимает промежуточное положение между Afw и Мч и зависит от используемого растворителя.
Обе прямые должны пересекаться на оси ординат в точке, соответствующей нулевой концентрации. Если прямые не пересекаются в этой точке, то за предельное число вязкости берется значение, соответствующее средней точке между пересечениями оси ординат каждой прямой. Определив значение ], при известных величинах К и а ( см. табл. 11.4) по уравнению Марка-Хувинка определяют средневязкостную молекулярную массу полимера.
|
Прибор для фракционирования дробным растворением. |
Колбы, в которых проводилось упаривание, ополаскивают небольшим количеством бензола и присоединяют его к раствору в колбе Эрленмейера. Колбу Эрленмейера помещают в вакуум-сушильный шкаф и сушат до постоянной массы при 50 С. Затем определяют для каждой фракции массу р, и средневязкостную молекулярную массу Mi.
Через 4 ч ампулы вскрывают и их содержимое выливают в чашки Петри; полимеризацию прекращают добавлением в каждый образец по 0 5 мл кротоно-вого альдегида. Растворители и непрореагировавший мономер откачивают под вакуумом при 60 С. После взвешивания около 1 г каждого из образцов растворяют в 20-кратном количестве метанола и высаживают в воду. Заполняют таблицу, в которой растворители располагаются согласно их влиянию на конверсию и средневязкостную молекулярную массу полученных образцов.
Методики определения молекулярной массы
За последние десятилетия разработаны многочисленные методы определения ММ полимерных материалов различной степени точности. Условно все методы можно разделить на две группы:
-
1. Абсолютные. Их результаты независимы от используемой модели макромолекулы.
-
2. Относительные. Они используют калибровочные зависимости, применяющиеся с учетом модели макромолекулы.
Абсолютные методы позволяют получить непосредственное значение ММ полимера или степени его полимеризации. Наиболее распространенными абсолютными методиками считаются:
-
1) Способ определения осмотического давления.
-
2) Способ ультрацентрифугирования.
-
3) Способы светорассеяния.
-
4) Химические методики, например способ подсчета концевых функциональных групп, метод криоскопии.
Относительные методы названы так, потому что измеряют некоторое свойство полимера, прямо зависящее от его ММ. Таким свойством может быть степень растворимости в конкретном растворителе или вязкость раствора. Конечно, для определения ММ полимера с использованием данного метода нужно обладать соответствующей градуировочной кривой, составленной при сравнении с показателями по какому-то из абсолютных методов. Одним из важнейших и часто используемых относительных способов получения значений молекулярных масс полимерных материалов считается методика измерения вязкости «по Штаудингеру». Известный исследователь коллоидных растворов Герман Штаудингер был пионером в изучении связи вязкости полимерных растворов небольших концентраций с молекулярной массой. Он установил и описал взаимосвязь между ними.
Структура, свойства и применение радиационных регенераторов резин на основе бутилкаучука моногррафия
КГТУ
Монография посвящена исследованиям радиационной деструкции резин
на основе бутилкаучука. Изучены кинетические закономерности и
особенности радиационной деструкции резин на основе бутилкаучука, в
зависимости от состава, типа вулканизующего агента (сера,
алкилфенолоформальдегидные смола, нитрозосоединения), природы и
содержания наполнителей, закономерности и возможности радиационной
деструкции резин на основе радиационных регенератов бутилкаучука.
Изучены особенности вулканизации радиационных бутилрегенератов
различными вулканизующими агентами, исследовано термическое старение резин на основе радиационных регенератов бутилкаучука и их устойчивость в агрессивных средах. Описаны технологические решения радиационной деструкции резин на основе бутилкаучука на ускорителе электронов и с помощью γ-облучения (Со60) а также области применения радиационных регенератов бутилкаучука.
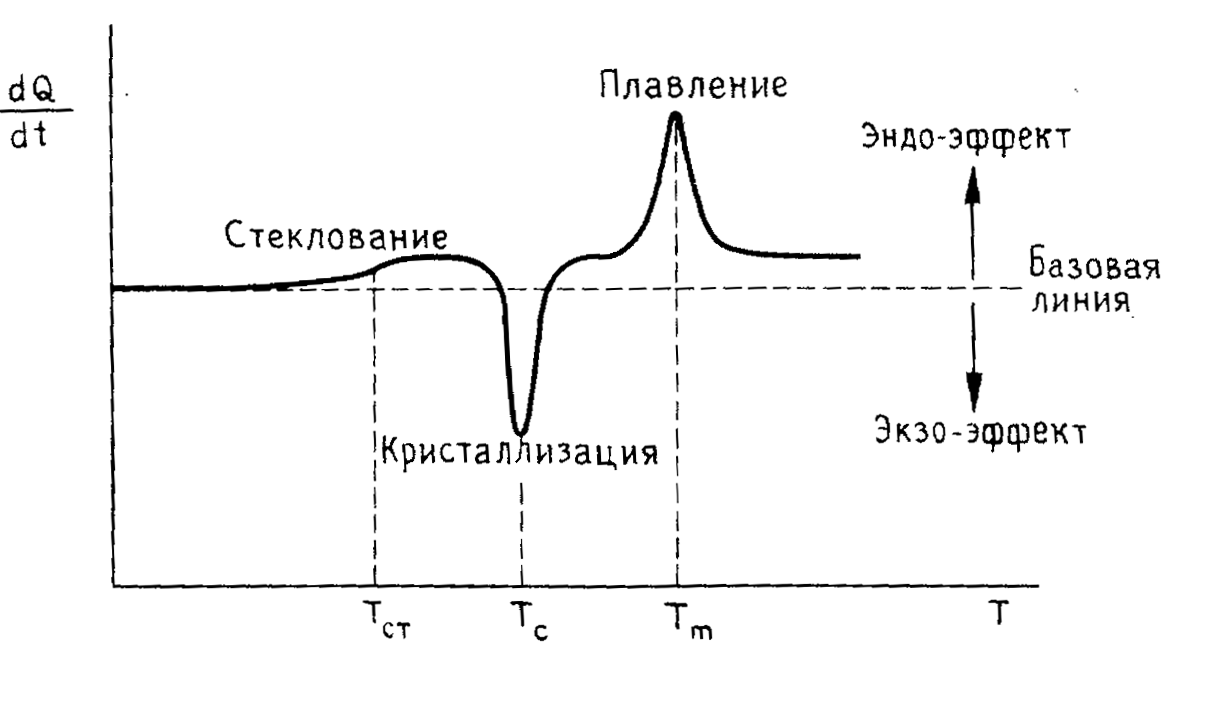
газообразования GR радиационно-химический выход радикалов Мn среднечисленная молекулярная масса Mη средневязкостная <…> (расч.) 345 34,1 18,1 7,5 3,8 Средневязкостная Мŋ, тыс. 380 41,5 21,4 5,3 3,0 Дроздовским показано, что <…> при облучении БК дозой 20*106 рентген (~175 кГр) происходит уменьшение средневязкостной молекулярной
Предпросмотр: Структура, свойства и применение радиационных регенераторов резин на основе бутилкаучука. Монография.pdf (0,2 Мб)
Газы и пары.
Согласно закону Авогадро, в равных объемах газов при одинаковых давлении и температуре содержится одинаковое число молекул. Следовательно, один моль любого газа при данных температуре и давлении должен занимать один и тот же объем (один из законов идеальных газов; см. ХИМИЯ). С учетом поправок на неидеальность объем одного моля (6,02Ч1023 молекул) любого газа при 0° С и 1 атм равен 22,414 л. На основании закона Авогадро находят мол. массу газообразных веществ. В общих чертах процедура состоит в следующем. Определяют массу известного объема газа при данных давлении и температуре. После введения поправок на неидеальность приводят объем к условиям 0° С и 1 атм, используя уравнение состояния идеального газа PV = RT, где R – газовая постоянная. Зная массу и объем идеального газа при °С и 1 атм, нетрудно рассчитать массу 22,414 л газа, т.е. его мол. массу. Этим методом были получены точные значения мол. масс, которые использовались даже для определения атомных масс. Для приближенной оценки мол. массы газ считают идеальным и никаких поправок не делают.
Данный метод часто применяют при определении мол. масс летучих жидкостей и твердых веществ. Для этого используют уравнение состояния газа в виде PV = wRT/M (уравнение Клапейрона – Менделеева), где w – масса паров вещества с мол. массой М, занимающих объем V при температуре Т и давлении Р. Если Р выражено в атм, а V – в см3 или мл, то R = 82,06. Отсюда получаем M = wRT/PV и, зная все величины в правой части, находим мол. массу паров вещества. Для определения таким методом мол. масс летучих жидкостей и твердых веществ было создано несколько устройств. Наибольшее распространение получил прибор немецкого химика В.Мейера (1878) – длинная вертикальная трубка, закрытая сверху и расширяющаяся книзу в виде конической колбы, окруженная нагревательной рубашкой. Известное количество изучаемой жидкости (или твердого вещества) помещали на дно колбы и испаряли. При испарении эквивалентный объем воздуха вытеснялся через боковой отвод вверху трубки в измерительное устройство. Объем вытесненного воздуха, измеренный при температуре и давлении окружающей среды, равен объему паров изучаемого вещества в этих же условиях. Зная w, Т и Р, можно вычислить М – мол. массу паров вещества. Усовершенствовав аппарат В.Мейера, можно было проводить измерения при температурах до 2000° С.
Объемы газов
Как известно, все окружающие нас вещества могут пребывать в твердом, жидком или газообразном агрегатном состоянии. Для твердых тел наиболее распространенной базовой мерой является масса, для твердых и жидких – объем. Это связано с тем, что твердые тела сохраняют свою форму и конечные размеры, Жидкие и газообразные вещества конечных размеров не имеют. Особенность любого газа состоит в том, что между его структурными единицами – молекулами, атомами, ионами — расстояние во много раз больше, чем такие же расстояния в жидкостях или твердых телах. Например, один моль воды в нормальных условиях занимает объем 18 мл – приблизительно столько же вмещается в одну столовую ложку. Объем одного моля мелкокристаллической поваренной соли – 58,5 мл, а объем 1 моля сахара больше моля воды в 20 раз. Для газов места требуется еще больше. Один моль азота при нормальных условиях занимает объем, в 1240 раз больший, чем один моль воды.

Таким образом, объемы газообразных веществ существенно отличаются от объемов жидких и твердых. Это обусловлено разностью растояний между молекулами веществ в различных агрегатных состояниях.
СТРУКТУРА ХРОМОГЕННЫХ КОРПУСКУЛ АЗУЛЕНА [Электронный ресурс] / Михеев, Гусева, Заиков // Известия высших учебных заведений. Химия и химическая технология .— 2012 .— №5 .— С. 1-15 .— Режим доступа: https://rucont.ru/efd/421739
На основании анализа оригинальных и литературных данных показано, что в растворах, кристаллическом и газообразном состоянии азулен существует в виде обратимо превращающихся друг в друга супрамолекулярных димеров (I и II), поглощающих свет в одной и той же видимой (VIS) области спектра, но отличающихся взаимной ориентацией молекул. Характерная для димеров I спектральная VIS-полоса отличается от VIS-полосы димеров II наличием вибронной структуры. Сделан вывод, что синий цвет азулена связан не с фотовозбуждением электронов внутри отдельных Az-молекул, а с оптическими переходами, затрагивающими супрамолекулярные димеры в целом, как было ранее установлено для фталоцианиновых, трифенилметановых, ксантеновых и тиазиновых красителей. Из полученных результатов следует, что традиционное представление о нарушении правила Каши при флуоресценции азулена является неверным: эмиссия света идет не с постулированного в литературе молекулярного уровня S2, а с уровня S1.
Высокомолекулярные соединения. Ч. 1 метод. указания
ЯрГУ
В методических указаниях рассмотрены основные методы синтеза, выделения, идентификации и исследования свойств полимеров. В начале каждого раздела приведено краткое теоретическое введение. Далее описываются подробные экспериментальные методики и даются практические советы.
величин К и α взят нефракционированный молекулярногетерогенный полимер, то получается приближенный средневязкостный <…> Для большинства высокополимеров средневязкостный молекулярный вес гораздо ближе к средневесовому, чем
Предпросмотр: Высокомолекулярные соединения Методические указания.pdf (0,9 Мб)
Средняя молярная масса
Средняя молярная масса M¯{\displaystyle {\bar {M}}} смеси нескольких индивидуальных веществ с разными молярными массами M1,M2…Mn{\displaystyle M_{1},M_{2}…M_{n}} может быть вычислена через мольные доли x1,x2…xn{\displaystyle x_{1},x_{2}…x_{n}} веществ в смеси как среднее арифметическое взвешенное мольных долей:
- M¯=∑i=1nxiMi∑i=1nxi=∑i=1nxiMi,{\displaystyle {\bar {M}}={\frac {\sum _{i=1}^{n}x_{i}M_{i}}{\sum _{i=1}^{n}x_{i}}}=\sum _{i=1}^{n}x_{i}M_{i},}
так как ∑i=1nxi=1.{\displaystyle \sum _{i=1}^{n}x_{i}=1.}
Если состав вещества задан через массовые доли w1,w2…wn{\displaystyle w_{1},w_{2}…w_{n}} индивидуальных веществ, то средняя молярная масса определяется через среднее гармоническое взвешенное массовых долей:
- M¯=∑i=1nwi∑i=1nwiMi=1∑i=1nwiMi.{\displaystyle {\bar {M}}={\frac {\sum _{i=1}^{n}w_{i}}{\sum _{i=1}^{n}w_{i}/M_{i}}}={\frac {1}{\sum _{i=1}^{n}w_{i}/M_{i}}}.}
Средняя молярная масса важна для смесей газов, так как входит в термодинамические уравнения состояния газовых смесей.
Например, молярная масса воздуха Ma¯{\displaystyle {\bar {M_{a}}}}, в предположении, для простоты пренебрегаем другими газами, что он состоит на 23,2 масс. % (21 об. %) из кислорода, 75,4 масс. % (78 об. %) азота и 1,4 масс. % (1 об. %) аргона (молярные массы 32; 28 и 40 г/моль соответственно) даёт для средней молярной массы воздуха:
- Ma¯=21⋅32+78⋅28+1⋅40100=10075,428+23,232+1,440=28,96{\displaystyle {\bar {M_{a}}}={\frac {21\cdot 32+78\cdot 28+1\cdot 40}{100}}={\frac {100}{75,4/28+23,2/32+1,4/40}}=28,96} г/моль.
Более точный расчет средней молярной массы сухого воздуха дает 28,97 г/моль.
Для высокомолекулярных веществ, состоящих из молекул с разной молярной массой, например, полимеров, иногда указывают среднюю молярную массу или диапазон молярных масс.
ОБНАРУЖЕНИЕ И ОПРЕДЕЛЕНИЕ АГРЕГАТОВ ХИТОЗАНА КАПИЛЛЯРНЫМ ЗОННЫМ ЭЛЕКТРОФОРЕЗОМ С ПРИМЕНЕНИЕМ ДАВЛЕНИЯ [Электронный ресурс] / Джераян [и др.] // Журнал аналитической химии .— 2017 .— №3 .— С. 67-73 .— Режим доступа: https://rucont.ru/efd/583625
Предложен новый подход к обнаружению и определению агрегатов хитозана в уксуснокислых растворах методом капиллярного зонного электрофореза с применением давления. Исследованы процессы агрегирования хитозана в зависимости от состава дисперсионной среды и времени хранения. Впервые обнаружено присутствие нескольких видов положительно заряженных агрегатов хитозана. Методами сканирующей электронной микроскопии, статического и динамического светорассеяния определены размеры частиц, изменяющиеся в интервале 20–2500 нм. Установлена зависимость вида электрофореграмм от полученных в тех же условиях распределений частиц по размеру. Установлена тенденция изменения электрофоретической подвижности в зависимости от размера агрегата, позволяющая приблизительно оценивать полидисперсность растворов хитозана. Хитозан использован для эффективной динамической модификации капилляров, не требующей введения модификатора в фоновый электролит
Измерение
Молярные массы почти никогда не измеряются непосредственно. Они могут быть вычислены от стандартных атомных масс и часто перечисляются в химических каталогах и на справочных листках безопасности изделия (MSDS). Молярные массы, как правило, варьируются между:
:1-238 г/молекулярные массы для атомов естественных элементов;
:10-1000 г/молекулярные массы для простых химических соединений;
:1000-5 000 000 г/молекулярные массы для полимеров, белков, фрагментов ДНК, и т.д.
В то время как молярные массы почти всегда, на практике, вычисляются от атомных весов, они могут также быть измерены в определенных случаях. Такие измерения намного менее точны, чем современные массовые спектральные измерения атомных весов и молекулярных масс, и представляют главным образом исторический интерес
Все процедуры полагаются на colligative свойства, и любое разобщение состава должно быть принято во внимание
Плотность пара
Измерение молярной массы плотностью пара полагается на принцип, сначала изложенный Амедео Авогадро, это равняется объемам газов при идентичных условиях, содержат равные количества частиц. Этот принцип включен в идеальное газовое уравнение:
где n — количество вещества. Плотность пара (ρ) дана
Объединение этих двух уравнений дает выражение для молярной массы с точки зрения плотности пара для условий известного давления и температуры.
Депрессия точки замерзания
Точка замерзания решения ниже, чем тот из чистого растворителя, и депрессия точки замерзания (ΔT) непосредственно пропорциональна концентрации суммы для разведенных решений. Когда состав выражен как molality, постоянная пропорциональность известна как cryoscopic константа (K) и характерна для каждого растворителя. Если w представляет массовую фракцию раствора в решении, и принимающий разобщение раствора, молярная масса дана
Повышение температуры кипения
Точка кипения раствора involatile раствора выше, чем тот из чистого растворителя, и повышение температуры кипения (ΔT) непосредственно пропорционально концентрации суммы для разведенных решений. Когда состав выражен как molality, постоянная пропорциональность известна как ebullioscopic константа (K) и характерна для каждого растворителя. Если w представляет массовую фракцию раствора в решении, и принимающий разобщение раствора, молярная масса дана
Задачи на количество вещества
Пример 1. Сколько граммов Н2, Н2O, СН3ОН, октана (С8Н18) и газа неона (Ne) содержится в 1 моле?
Решение: Молекулярные массы (в атомных единицах массы) перечисленных веществ приведены в таблице Менделеева. 1 моль каждого из названных веществ имеет следующую массу:
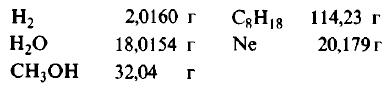
Поскольку массы, указанные в решении примера 1, дают правильные относительные массы взвешиваемых молекул, указанная масса каждого из перечисленных веществ содержит одинаковое число молекул. Этим и удобно использование понятия моля. Нет даже необходимости знать, чему равно численное значение моля, хотя мы уже знаем, что оно составляет 6,022·1023; эта величина называется числом Авогадро и обозначается символом NA. Переход от индивидуальных молекул к молям означает увеличение шкалы измерения в 6,022·1023 раз. Число Авогадро представляет собой также множитель перевода атомных единиц массы в граммы: 1 г = 6,022·1023 а.е.м. Если мы понимаем под молекулярной массой массу моля вещества, то ее следует измерять в граммах на моль; если же мы действительно имеем в виду массу одной молекулы, то она численно совпадает с молекулярной массой вещества, но выражается в атомных единицах массы на одну молекулу. Оба способа выражения молекулярной массы правильны.
Пример 2. Сколько молей составляют и сколько молекул содержат 8 г газообразного кислорода O2?
Решение: Выписываем из таблицы Менделеева атомную массу атома кислорода (O), которая равна 15,99 а.е.м, округляем до 16. Так как у нас молекула кислорода, состоящая из двух атомов O, то ее атомная масса равна 16×2=32 а.е.м. Хорошо, а теперь переводим ее в молярную массу: 32 а.е.м = 32 г/моль. Это означает, что 1 моль (6,022·1023 молекул) O2 имеет массу 32 грамма. Ну и в заключении по формулам выше находим количество вещества (моль) и число молекул, содержащихся в 8 граммах O2:
- n = m / M = 8г / 32г/моль = 0,25 моль
- N = NA × n = 6,022·1023 × 0,25 = 1,505·1023 молекул
Пример 3. 1 молекула Н2 реагирует с 1 молекулой Сl2, в результате чего образуются 2 молекулы газообразного хлористого водорода НСl. Какую массу газообразного хлора необходимо использовать, чтобы он полностью прореагировал с 1 килограммом (кг) газообразного водорода?
Решение: Молекулярные массы H2 и Cl2 равны 2,0160 и 70,906 г/моль соответственно. Следовательно, в 1000 г H2 содержится
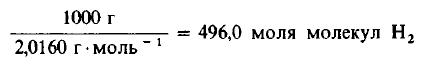
Даже не выясняя, сколько молекул содержится в одном моле вещества, мы можем быть уверены, что 496 моля Cl2 содержат такое же число молекул, как и 496,0 моля, или 1000 г, H2. Сколько же граммов Cl2 содержится в 496 молях этого вещества? Поскольку молекулярная масса Cl2 равна 70,906 г/моль, то
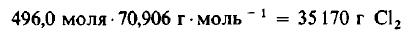
Пример 4. Сколько молекул H2 и Cl2 принимает участие в реакции, описанной в примере 3?
Решение: В 496 молях любого вещества должно содержаться 496 моля × 6,022·1023 молекул/моль, что равно 2,99·1026 молекул.
Чтобы наглядно показать, сколь велико число Авогадро, приведем такой пример: 1 моль кокосовых орехов каждый диаметром 14 сантиметров (см) мог бы заполнить такой объем, какой занимает наша планета Земля. Использование молей в химических расчетах рассматривается в следующей главе, но представление об этом пришлось ввести уже здесь, поскольку нам необходимо знать, как осуществляется переход от молекулярной шкалы измерения масс к лабораторной шкале.
Надеюсь урок 5 «Моль и молярная масса» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
Похожие:
| Лабораторная работа 1 4 лабораторная работа 2 13 лабораторная работа…Интернете разнообразную информацию – описательную, графическую, картографическую и пр. При разработке сайтов необходимо уметь работать… | Программа вступительного испытания для поступающих на программу подготовки…Первое и второе начала термодинамики. Термодинамическое и статистическое определение энтропии. Неравенство Клаузиуса | ||
| Лабораторная работа №8 распределенный udp сервер/ udp клиент 38 Лабораторная…Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования | Лабораторная работа №1Определение зернового состава крупного заполнителя бетона – щебня | ||
| Лабораторная работа №1 «Изучение работы вольтметров»Лабораторная работа №3 «Измерение параметров синусоидальных сигналов осциллографом» | Лабораторная работа. «Определение температуры размягчения битума»Требования, предъявляемые к битумам, особенно дорожным, весьма разнообразны. Дорожные битумы должны | ||
| Лабораторная работа №6 «качественное определение воспламеняемости…Федерального государственного бюджетного образовательного учреждения высшего профессионального образования | Лабораторная работа №10Цель работы: сформировать умение определять работу и мощность постоянного электрического тока с помощью амперметра и вольтметра | ||
| Лабораторная работа. «Определение смолисто-асфальтеновых веществ в битуме»Они совсем не содержат асфальтенов. В других нефтях метанового основания их содержание не превышает нескольких процентов | Университет «мами» Кафедра физики лабораторная работа 08 Изучение дифракции рентгеновскихЦель работы: определение расстояний между атомными плоскостями в кристалле по имеющейся рентгенограмме |
Литература
Расчет объема 1 моля газа
В качестве примера несложно выполнить расчет одного моля любого газа, например азота. Для этого сначала нужно найти значение его относительной молекулярной массы:
Мr(N2)= 2×14=28.
Поскольку относительная молекулярная масса вещества численно равна молярной, то M(N2)=28 г/ моль.
Опытным путем выяснено, что при нормальных условиях плотность азота равна 1,25 г/литр.
Подставим это значение в стандартную формулу, известную со школьного курса физики, где:
- V — объем газа;
- m — масса газа;
- ρ — плотность газа.
Получим, что молярный объем азота при нормальных условиях
V(N2)= 25г/моль : 1,25 г/ литр =22,4 л/ моль.
Получается, что один моль азота занимает 22,4 литра.
Если выполнить такую операцию со всеми существующими газовыми веществам, можно прийти к удивительному выводу: объем любого газа при нормальных условиях равен 22,4 литра. Вне зависимости от того, о каком газе идет речь, какова его структура и физико-химические характеристики, один моль этого газа будет занимать объем 22,4 литра.

Молярный объем газа – одна из важнейших констант в химии. Эта постоянная позволяет решить многие химические задачи, связанные с измерением свойств газов при нормальных условиях.
Итоги
Молекулярная масса газообразных веществ важна для определения количества вещества. А если исследователь знает количество вещества того или иного газа, он может определить массу или объем такого газа. Для одной и той же порции газообразного вещества одновременно выполняются условия:
ν = m/ M ν= V/ Vm.
Если убрать постоянную ν, можно уравнять эти два выражения:
m / M = V/ Vm.
Так можно вычислить массу одной порции вещества и его объем, а также становится известной молекулярная масса исследуемого вещества. Применяя эту формулу, можно легко вычислить соотношение объем-масса. При приведении данной формулы к виду M= m Vm/V станет известна молярная масса искомого соединения. Для того чтобы вычислить это значение, достаточно узнать массу и объем исследуемого газа.
Следует помнить, что строгое соответствие реальной молекулярной массы вещества к той, что найдена по формуле, невозможно. Любой газ содержит массу примесей и добавок, которые вносят определенные изменения в его структуру и влияют на определение его массы. Но эти колебания вносят изменения в третью или четвертую цифру после запятой в найденном результате. Поэтому для школьных задач и экспериментов найденные результаты вполне правдоподобны.